Arrancamos 2023 con el anuncio de una nueva temporada del gustado formato de reuniones, Te Lo Tengo Que Preguntar.
No te pierdas los nuevos episodios, que traerán mucha mayor interacción con la comunidad de personas que viven con enfermedades raras en México.
¡Te Lo Tengo Que Preguntar, nueva temporada!
Día Internacional Gaucher 2020
Desde hace algunos años cada 1º de octubre se conmemora a nivel mundial el “Día Internacional Gaucher”, para dar a conocer esta enfermedad rara de depósito lisosomal de la cual hay 3 tipos: el tipo 1 que no presenta afectación neurológica, y los tipos 2 y 3 que sí la presentan. El tipo 1, que es el más común, afecta a 1 de cada 9 personas por cada 100,000 habitantes a nivel mundial, según cifras de Orphanet, aunque la incidencia en la comunidad judía es bastante más frecuente.
Quien padece esta enfermedad no produce, o produce de manera deficiente, una enzima encargada de degradar lípidos a nivel celular, provocando así que unas células llamadas macrófagos no funcionen y afecten órganos como el hígado, el bazo y los huesos, e incluso el cerebro en los tipos neuropáticos.
Los principales síntomas de la enfermedad de Gaucher son agrandamiento del bazo e hígado, anemia, moretones, sangrados de nariz, fatiga y dolor óseo crónico; además de esto, los tipos 2 y 3 presentan afectación neurológica siendo los principales síntomas estrabismo, convulsiones y una deficiente velocidad de respuesta ante algunos estímulos.
Junto con la Alianza Internacional Gaucher (IGA, por sus siglas en inglés) buscamos que haya consciencia en las autoridades de las instituciones públicas de salud de que las terapias en casa son la mejor opción para nuestros pacientes Gaucher: #CasaSÍHospitalesNO #IGD2020
Este año, dada la condición de la pandemia, los eventos para conmemorar este día se harán en línea, y desde el Proyecto Pide un Deseo México celebraremos con una edición especial del programa “Te Lo Tengo Que Preguntar”. En esta edición especial COMUNIDAD GAUCHER, nos acompañarán médicos, enfermeras, familiares y, por supuesto, pacientes que conviven y trabajan día a día con esta enfermedad. En el programa conoceremos el muy personal punto de vista de cada uno de ellos respecto a lo que significa y ha significado la enfermedad de Gaucher en sus vidas. ¿Nos acompañas?
¿QUÉ? #TeLoTengoQuePreguntar, edición COMUNIDAD GAUCHER.
¿CUÁNDO? Jueves 1 de octubre de 7:30 a 8:30 p.m.
¿DÓNDE? Facebook Live de Proyecto Pide un Deseo México.
¿CÓMO? Sólo conéctate ese día y disfruta del programa, pues es un #EventoGRATUITO.
Mejores prácticas sobre intercambio o remplazo de medicamento para Gaucher

Remplazo y seguimiento. Mejores prácticas para la enfermedad de Gaucher.
Un documento con consenso. Publicado en octubre de 2023.
Preparado por el Grupo de Trabajo Internacional sobre la Enfermedad de Gaucher (IWGGD) y la Alianza Internacional Gaucher (IGA).
Recientemente, los pacientes que viven con la enfermedad de Gaucher, sus cuidadores, los familiares y las organizaciones de pacientes estamos cada vez más preocupados por las circunstancias que conlleva cambiar los medicamentos utilizados para tratar esta rara enfermedad.
En muchos países, hay medicamentos disponibles cuya seguridad y eficacia han sido demostradas formalmente, a través de programas de investigación clínica y décadas de evidencia del mundo real. Estos medicamentos respaldados pueden mejorar tanto el funcionamiento físico como la calidad de vida y brindar confianza a las familias y a los pacientes que usan un medicamento respaldado por evidencia clínica sólida.
Es de esperar que los proveedores de atención médica busquen adquirir medicamentos costosos al precio más competitivo; sin embargo, el costo no debe tener prioridad sobre la seguridad y la eficacia.
Es posible que algunos medicamentos que recientemente se han puesto a disposición de pacientes en algunas partes del mundo no tengan niveles suficientes de evidencia clínica disponible.
Como defensores de la atención sanitaria, tanto los médicos como las organizaciones de pacientes tienen la responsabilidad de abordar los estándares de evidencia clínica que esperaríamos de los nuevos medicamentos.
La terminología utilizada para describir medicamentos considerados similares a sus predecesores y, por lo tanto, no sujetos a un nivel equivalente de generación de evidencia difiere. A los efectos de este documento de consenso, hemos utilizado la palabra “no comparables” para describir aquellos medicamentos que no tienen el mismo nivel de evidencia clínica que los medicamentos establecidos.
En el documento de consenso [anexo; solo disponible, por el momento, en inglés] hemos enumerado los puntos que los responsables de la toma de decisiones deberían considerar antes de aprobar un nuevo medicamento por motivos puramente económicos.
IWGGD & IGA – Consensus Switching and Monitoring Best Practice for Gaucher.
Compartimos, asimismo, el último folleto sobre el diagnóstico de Gaucher, también preparado por IGA:
Día Internacional de Gaucher… en Querétaro
Un día soleado y con una vista espectacular es lo que nos obsequió el Instituto de Hematopatología, dirigido por el experto Dr. Joaquín Carrillo Farga y localizado en el estado de Querétaro, para celebrar el Día Internacional de Gaucher, 1.º de octubre de 2023.
Además de pacientes, también participaron con sendas charlas el vocero nuestra asociación, Toto Peña, y la directora de AcceSalud, Pali Peña. Para rematar, el Dr. Carrillo nos obsequió una charla muy interesante sobre los aspectos médicos de la enfermedad de Gaucher.
Seguimos al frente de la batalla
Hola, soy el papá de Pali y Toto. Permítanme compartirles lo siguiente.
Hace 33 años, Gaucher irrumpió en nuestras vidas. Desde entonces y hasta hoy, la enfermedad ha sido compañera inseparable de mis hijos y del círculo más cercano a ellos. No ha habido, en todos estos años, un solo día en que nos pudiéramos olvidar del padecimiento. Y aunque hoy los aciagos días del pasado son un recuerdo, todavía no está solucionado el tema. Pues si bien la enfermedad está bajo control, ciertamente gravita todo el tiempo, aunque diferente que en un principio, sigue representando una pesada carga que aún llevamos a cuestas todos los involucrados.
Desde aquí, envío un abrazo para quienes, como nosotros, son el frente de batalla que nunca se da por vencido. Mi reconocimiento, para todos ustedes.
Hoy 1.º de octubre de 2023 conmemoramos el Día Internacional de Gaucher #IGD2023 #mydiagnosticjourney #RareButNotAlone
Fuente de la imagen de cubierta: Photo 39354600 © Rangizzz | Dreamstime.com
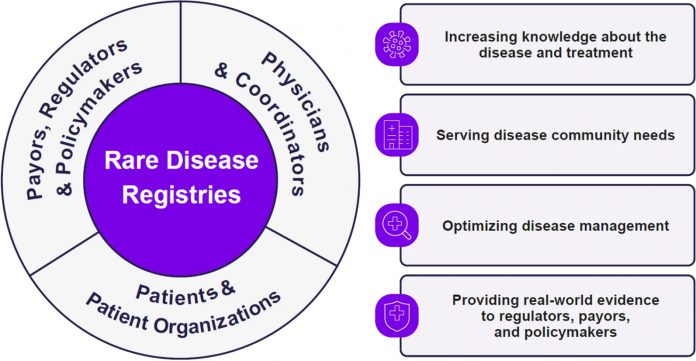
Registros de enfermedades lisosomales: lecciones aprendidas
Registros de enfermedades lisosomales: lecciones aprendidas en tres décadas de evidencia del mundo real.
Los trastornos de almacenamiento lisosomal (LSD, por sus siglas en inglés) son enfermedades raras causadas por deficiencias heredadas de enzimas o de transportadores lisosomales. Afectan a 1 en 7000 u 8000 recién nacidos. Los individuos con LSD se enfrentan a largos peregrinajes de diagnóstico, durante los cuales pueden ocurrir eventos debilitantes y potencialmente mortales.
Los ensayos clínicos y las descripciones clásicas de las LSD suelen centrarse en las manifestaciones comunes, que no son representativas de la vasta heterogeneidad fenotípica que se encuentra en la experiencia del mundo real.
Además, reconociendo que había una comprensión limitada de la historia natural, de la progresión de las enfermedades y de los resultados clínicos en el mundo real de los LSD raros, una asociación colaborativa fue pionera hace 30 años para corregir estas lagunas. Los registros de las enfermedades raras (RDR, por sus siglas en inglés) Gaucher, Fabry, mucopolisacaridosis tipo I y Pompe representan la base de datos de observación más grande para estos LSD.
En los últimos treinta años, los datos de los RDR han ayudado a informar sobre la comprensión científica y el desarrollo de las directrices integrales de monitoreo y tratamiento. Para ello fue necesario crear un marco de trabajo para la recopilación de datos y al establecimiento de un estándar de atención médica, cuyo objetivo general es el mejorar la calidad de vida de los pacientes afectados.
En el artículo mencionado más abajo se destacan la historia, el proceso y el impacto de los RDR y los autores analizan las lecciones aprendidas y las futuras direcciones.
https://ojrd.biomedcentral.com/articles/10.1186/s13023-022-02517-0#Sec13
Mistry, P.K., Kishnani, P., Wanner, C. et al. Rare lysosomal disease registries: lessons learned over three decades of real-world evidence. Orphanet J Rare Dis 17, 362 (2022). https://doi.org/10.1186/s13023-022-02517-0
(Este artículo de nuestro blog fue posible gracias al apoyo de Takeda México).
Postura de IGA sobre las medicinas no comparables
La Alianza Internacional de Gaucher (IGA, por sus siglas en inglés) ha publicado una declaración de posición sobre el uso de medicamentos no comparables para la enfermedad de Gaucher. La declaración resume la postura de la IGA sobre el uso de «copias previstas» de medicamentos de terapia de sustitución enzimática (TRE) como tratamiento para la enfermedad de Gaucher. Estas «copias» también se conocen como no comparables, porque no se han comparado directamente con el medicamento original.
Los no comparables son copias de medicamentos biológicos autorizados que no han seguido las rigurosas vías reglamentarias exigidas para los medicamentos biosimilares, los cuales están estrictamente regulados por la Agencia Europea de Medicamentos (EMA), la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) y la Agencia Japonesa de Productos Farmacéuticos y Dispositivos Médicos (PDMA), para garantizar que son tan seguros y eficaces como el producto de referencia. Por lo tanto, es difícil saber cómo se comportará un medicamento no comparable en términos de eficacia, seguridad y calidad.
La IGA acoge con satisfacción la disponibilidad de nuevos medicamentos, ya que esto ofrece un mejor acceso y mayores opciones de tratamiento para los pacientes. Sin embargo, somos conscientes de los retos que plantea la forma en que los no comparables podrían utilizarse o intercambiarse con otros medicamentos aprobados. En particular, a IGA le preocupan:
- La falta de datos sobre seguridad y eficacia.
- La falta de información precisa sobre el producto.
- La falta de claridad sobre cómo se han realizado las aprobaciones locales.
- La forma cómo se informa a los pacientes sobre estas opciones de tratamiento, ya que esto tiene el potencial de provocar ansiedad en la comunidad de pacientes y crear falsas expectativas.
El uso de no comparables para el tratamiento de la enfermedad de Gaucher es una realidad en muchos países. La situación actual es insatisfactoria, pero la IGA cree que muchos de los problemas actuales pueden resolverse adoptando medidas específicas.
«Hemos hecho varias recomendaciones para que el uso de medicamentos no comparables sea más seguro», declaró Tanya Collin-Histed, directora general de la IGA. «Por ejemplo, que la denominación y el etiquetado de los medicamentos indiquen claramente si se trata de un medicamento no comparable, que todos los envases incluyan información precisa sobre el producto, que los datos sobre seguridad y eficacia sean sólidos y que se mejore la orientación e información sobre los medicamentos no comparables».
Collin-Histed añade: «Los grupos comunitarios deben colaborar directamente con los fabricantes de medicamentos no comparables. Deberíamos intentar establecer un diálogo positivo con los fabricantes de no comparables en la enfermedad de Gaucher y explorar las oportunidades de colaboración mutua que beneficien a todas las partes».
Puede leer el texto completo de la declaración de posición de IGA [en español] en: https://gaucheralliance-org.translate.goog/iga-issues-position-statement-on-non-comparable-medicines/?_x_tr_sl=en&_x_tr_tl=es
(Este artículo de nuestro blog fue posible gracias al apoyo de Takeda México).
Encuesta mundial: ¿Es necesario tamizar a los recién nacidos con enfermedades lisosomales?
FEMEXER y Proyecto Pide un Deseo México apoyan esta iniciativa.
¡Encuesta disponible ahora! ¡Haz la nueva encuesta de #RareBarometer[1] y comparte tu opinión sobre el tamizaje neonatal para detectar enfermedades raras! ¿Las enfermedades raras se deben tamizar al nacer? La encuesta está disponible aquí en 24 idiomas: tiny.cc/survey_NBS_RD.
Rellenar la encuesta no te llevará más de 20 minutos. El periodo en el que estará abierta finaliza el 9 de julio de 2023. ¡Apresúrate! La encuesta está abierta a las personas que viven con una enfermedad rara y sus familias, de cualquier país del mundo. Está traducida a 24 idiomas.
Al hacer preguntas sobre los posibles beneficios y desventajas del cribado de enfermedades raras en los recién nacidos, por ejemplo, en términos de ansiedad, acceso a la atención o ajustes en la vida familiar, podremos abogar por un mejor enfoque para el tamizaje neonatal.
Esta encuesta permitirá recopilar su opinión sobre el tamizaje de enfermedades raras en recién nacidos y comunicar hechos y cifras a los responsables de la toma de decisiones, para que su opinión se tenga en cuenta a la hora de configurar el futuro del tamizaje neonatal.
Puedes encontrar aquí más información sobre esta encuesta y la iniciativa de Rare Barometer en este enlace: https://www.eurordis.org/rare-barometer-launches-new-survey-on-newborn-screening/. Esta encuesta forma parte del proyecto de investigación Screen4Care. Para obtener más información, visite screen4care.eu.
Necesitamos su ayuda para garantizar la participación en la encuesta del mayor número posible de personas de la comunidad de enfermedades raras. ¡Cuantas más personas contesten la encuesta, más fuerte será nuestra voz!
[1] RareBarometer es un programa de Eurordis. La información completa sobre la encuesta a propósito del tamizaje neonatal se encuentra aquí: https://www.eurordis.org/rare-barometer-launches-new-survey-on-newborn-screening/.
Este artículo del blog y su difusión a través de nuestras redes sociales fueron posible gracias al generoso apoyo de Takeda México.
En abril, ¡celebramos a los Fabryllantes!
Junto con la Red Internacional de Fabry (FIN, por sus siglas en inglés), en abril queremos visibilizar a los heroicos y brillantes pacientes que viven con la enfermedad de Fabry. A ellos, a los que han sido fuertes con su enfermedad, les queremos homenajear. ¡Son héroes en nuestra comunidad!
Mira en el sitio web fabryheroes.com y aprende más sobre esta enfermedad lisosomal.
Agradecemos el generoso apoyo de Takeda México,
sin el cual no hubiera sido posible este artículo del blog.