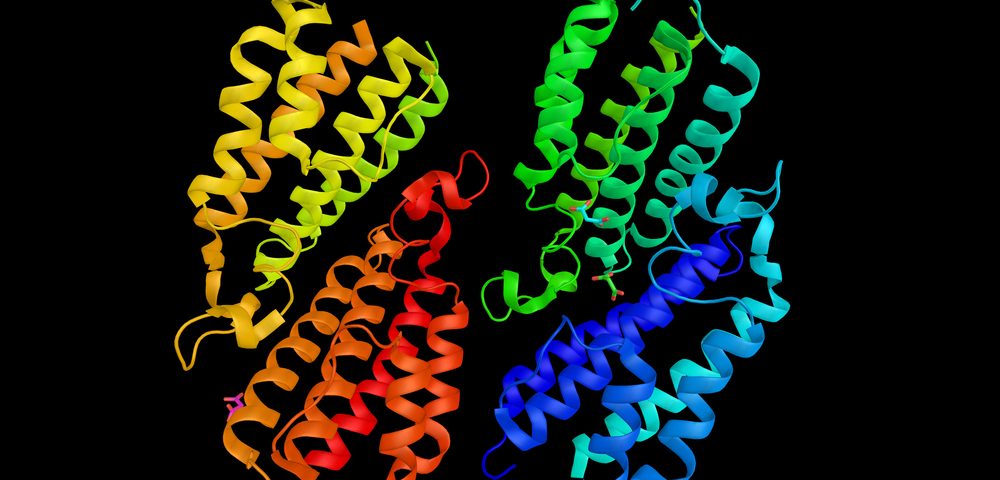
Usando enfoques de aprendizaje automático, los investigadores descubrieron cómo ciertas mutaciones en el gen GBA, responsables de la enfermedad de gaucher, afectan la función de la enzima glucocerebrosidasa a nivel molecular.
El estudio con ese hallazgo, «Mecanismo de activación y disfunción de la glucocerebrosidasa en la enfermedad de Gaucher desentrañado por la dinámica molecular y el aprendizaje profundo», se publicó en PNAS.
Se ha informado que cerca de 250 mutaciones diferentes en el gen GBA causan la enfermedad de Gaucher. Todas estas mutaciones afectan la función de la proteína (eso es lo que termina causando la enfermedad), pero no está claro exactamente cómo las mutaciones individuales evitan que la proteína funcione a nivel molecular.
Para investigar esto, los investigadores se enfocaron en dos mutaciones comunes: N370S, que representa aproximadamente el 70% de los casos de enfermedad de gaucher tipo 1, y L444P, que es responsable de aproximadamente el 40% de los casos de enfermedad de gaucher tipo 2 y tipo 3.
Específicamente, se preguntaron cómo estas mutaciones afectaron las interacciones entre la glucocerebrosidasa y otra proteína, la saposina C. Esta proteína ayuda a que la glucocerebrosidasa haga su trabajo y también evita que se degrade demasiado rápido, por lo que los cambios en la forma en que estas dos proteínas interactúan podrían tener efectos de gran alcance. En función de la proteína.
Para descubrir cómo las mutaciones mencionadas afectan la interacción de esta proteína, los investigadores utilizaron un conjunto complejo de modelos computarizados para simular cómo la glucocerebrosidasa mutante o normal interactúa con la saposina C. El modelo fue lo suficientemente preciso para predecir las interacciones y el movimiento a nivel de los átomos individuales.
El modelo de glucocerebrosidasa normal con saposina C de los investigadores fue, como era de esperar, bastante estable. Sin embargo, cuando se introdujo cualquiera de las mutaciones estudiadas, la estabilidad de los complejos proteicos modelados disminuyó significativamente.
Además, los cambios en la estructura de la glucocerebrosidasa causados por las mutaciones dificultaron la interacción del sitio activo de la enzima con sus sustratos, incluso en presencia de saposina C inalterada. En otras palabras, la glucocerebrosidasa mutante tenía una forma diferente, por lo que podría No se unen tan efectivamente a las moléculas con las que debería.
«Nuestros hallazgos proporcionan una explicación a nivel atomístico para la activación de la GCasa [glucocerebrosidasa] y el mecanismo preciso a través del cual N370S y L444P causan la enfermedad de Gaucher», concluyeron los investigadores en su artículo.
La comprensión adicional de cómo las mutaciones causantes de enfermedades afectan la función de la proteína en este nivel detallado puede proporcionar pistas para futuros estudios que buscan formas de tratar la enfermedad de Gaucher.
Marisa Wexler
Artículos relacionados: Gaucher, glucocerebrosidasa, mutaciones,
Fuente: http://bit.ly/2P4R9MN